Científicos americanos diseñan con IA interruptores que activan genes de forma específica en cada tejido
Un equipo científico de Estados Unidos ha logrado imitar los mecanismos naturales que regulan la expresión de genes, utilizando secuencias de ADN diseñadas con inteligencia artificial. Este avance promete superar uno de los mayores obstáculos en las terapias génicas: la activación precisa de genes sin afectar a otros tejidos. El trabajo ha sido publicado en el último número la revista Nature.
Fuente: Agencia SINC
Investigadores del Instituto de Tecnología de Massachusetts (MIT) y de las universidades de Harvard y Yale han diseñado interruptores de ADN capaces de controlar con precisión la expresión de genes en un tejido concreto sin afectar al resto del organismo, utilizando inteligencia artificial (IA) de aprendizaje profundo.
El avance permitiría superar uno de los principales obstáculos de la terapia génica. Además, estos reguladores serían más eficaces para fines terapéuticos que los reguladores naturales existentes en el genoma.
En concreto, el equipo, liderado por Ryan Tewhey, del Laboratorio Jackson, una organización de investigación biomédica independiente, han activado y desactivado genes de manera precisa en hígado, cerebro y riñón de ratones y peces cebra, tres tejidos que son modelos estándar en la investigación genómica. El trabajo ha sido publicado en el último número la revista Nature.
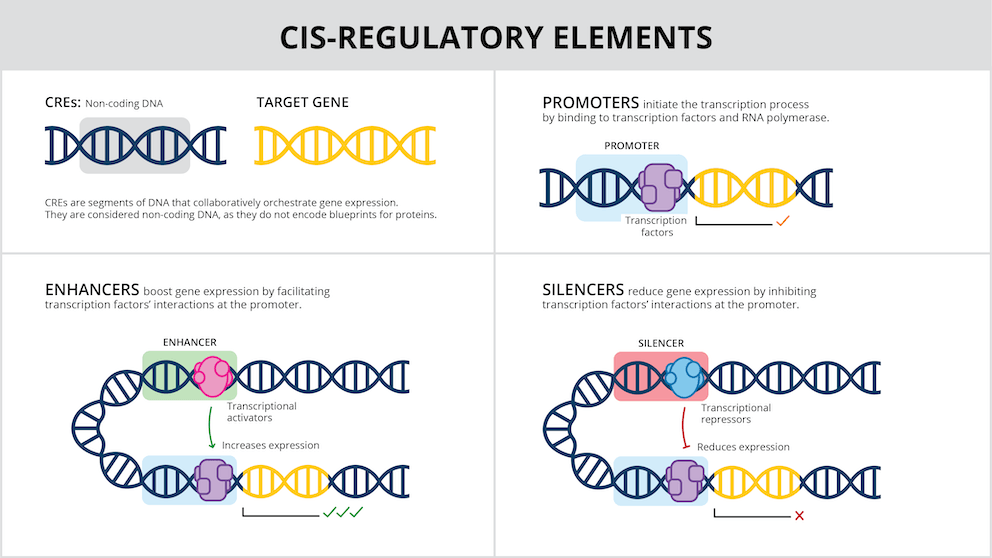
Representación gráfica de cómo actúan los elementos reguladores cis para activar o desactivar genes y abrir posibilidades a la medicina personalizada. / Instituto Broad del MIT y Harvard.
Cada tipo de célula del organismo tiene su propio ‘lenguaje’ para determinar si un gen se activará, cuándo y en qué circunstancias. Las instrucciones para activar o reprimir genes están codificadas en el genoma.
El objetivo de este trabajo ha sido precisamente aprender la ‘gramática reguladora’ de ese lenguaje relacionado con la regulación de los genes en diferentes tipos de células, explica en un comentario en Nature Andreas R. Pfenning, quien no ha participado en la estudio y cuyo laboratorio se especializa en construir herramientas genómicas computacionales aplicadas al estudio del cerebro. Para Pfenning, este trabajo refleja una tendencia más amplia hacia la aceleración de la biotecnología.
Identidad de cada tejido
Estos interruptores génicos artificiales generados en el laboratorio imitan la acción de los que existen de forma natural en el genoma, como los elementos reguladores cis (CRE, por sus siglas en inglés). Los CRE controlan la expresión génica, determinando la identidad de cada tejido, el tiempo de desarrollo y las respuestas a los estímulos en los miles de tipos de células del cuerpo.
En la última década, se han identificado millones de posibles CRE en el genoma, pero las secuencias generadas de forma natural a lo largo de la evolución representan solo un pequeño subconjunto de las posibles y queda por ver si podrían ser útiles en aplicaciones terapéuticas, señalan los investigadores.
Los autores del estudio actual probaron varias de las secuencias sintéticas de CRE en peces cebra y ratones. En concreto, lograron activar una proteína fluorescente en el hígado en desarrollo de los peces cebra sin activarse en ninguna otra parte del pez.
Asimismo, las pruebas in vivo mostraron que un ‘gen reportero’ (cuyo producto es fácilmente detectable y sirve como indicador) bajo la influencia de una de estas secuencias sintéticas de CRE específica para neuronas se expresaba solo en las neuronas del cerebro de ratones, pero no en la microglía ni en los astrocitos, los otros tipos de células cerebrales.
Esta expresión génica específica por tipo celular podría ser útil para dirigir las terapias génicas a poblaciones celulares concretas, subraya Pfenning en su comentario.
En estos modelos, los investigadores también comprobaron que las secuencias reguladoras sintéticas son más efectivas para impulsar la expresión específica en cada tipo de célula, en comparación con los reguladores naturales del genoma humano. Además, las secuencias sintéticas presentan un ‘vocabulario’ distintivo asociado con la actividad del tipo de célula objetivo y una reducción simultánea de su actividad en células no objetivo.
Hasta ahora, las terapias génicas han sido limitadas por la dificultad de aplicar tratamientos específicos para cada tipo celular. El funcionamiento tan preciso de estos interruptores artificiales podría abrir la puerta al diseño de terapias génicas con una alta precisión. Sin embargo, Rodrigo Castro, investigador del Laboratorio Jackson y coautor principal del artículo, es cauto y explica a SINC que aún no está claro “cuál será el alcance de esta investigación en relación con su posible impacto en las terapias génicas”.
Con respecto a la posibilidad de aplicar terapias génicas para enfermedades neurodegenerativas como el párkinson, caracterizado por la disminución de la producción de dopamina en un tipo específico de neuronas, Castro señala: “Aunque los potenciadores sintéticos que hemos probado in vivo mostraron una notable especificidad en el cerebro, creemos que aún queda mucho por hacer para determinar si estas secuencias potenciadoras selectivas serán útiles para combatir enfermedades neurodegenerativas”.
Sin embargo, agrega, “alcanzar este nivel de especificidad abre caminos prometedores en esta línea de investigación”.
El hecho de que los potenciadores mostraran especificidad en el cerebro de vertebrados no es una prueba definitiva de que la estrategia utilizada funcionará en organismos completos o que pueda aplicarse directamente a terapias génicas. “Después de todo, ese no era nuestro objetivo principal”, aclara Rodrigo Castro.
Aprendizaje automático y modelado genónimo
Este investigador considera que extender el trabajo a más tipos de células podría requerir técnicas innovadoras en el campo del aprendizaje automático y el modelado genómico, que reduzcan la carga experimental para los investigadores. La inteligencia artificial podría ser clave en este aspecto, acortando los tiempos de desarrollo.
“Por ahora, entrenar modelos que puedan predecir con precisión la función reguladora de secuencias de ADN requiere una cantidad considerable de datos experimentales, que pueden ser costosos o incluso no factibles. Los resultados de nuestro trabajo sugieren que dicha capacidad predictiva [de la IA] podría conducir a una especificidad aún mayor en organismos”.
En cualquier caso, destaca Castro, este resultado desafía las nociones previas sobre lo que se requiere para lograr tal especificidad en organismos y plantea nuevas posibilidades.
“El hecho de que el modelaje funcional en tres líneas celulares haya logrado esta especificidad a nivel del organismo completo sin duda abre emocionantes expectativas sobre hacia dónde se podría expandir este tipo de trabajo. Esperamos que, en el futuro, grupos especializados en terapias génicas puedan aplicar y extender nuestro trabajo en esa dirección”, concluye el coautor.
Referencia:
Gosai, S.J., Castro, R.I., Fuentes, N. et al. ‘Machine-guided design of cell-type-targeting cis-regulatory elements’. Nature (2024)
Últimas publicaciones
Un equipo de investigación de la Universidad de Jaén ha transformado el residuo sólido resultante tras extraer el aceite en un material carbonoso con alta capacidad para retener contaminantes. En pruebas de laboratorio eliminó prácticamente la totalidad de un colorante industrial utilizado como modelo, lo que refuerza su potencial en sistemas de depuración.
Sigue leyendoUn equipo de investigación de la Universidad de Jaén ha desarrollado un modelo de monitorización que combina dispositivos instalados en el hogar con inteligencia artificial para evaluar si las personas con enfermedades crónicas cumplen sus pautas médicas. La propuesta, en fase piloto, permite a los profesionales sanitarios comprobar si éstos toman la medicación y mantienen hábitos saludables como el sueño, la actividad física o la alimentación.
Sigue leyendoLa Fundación Descubre y la Universidad Pablo de Olavide, con la cofinanciación de la Consejería de Universidad, Investigación e Innovación y la Fundación Española para la Ciencia y la Tecnología – Ministerio de Ciencia, Innovación y Universidades, impulsan estas iniciativas en el marco del proyecto ‘Andalucía + ciencia ciudadana’. Científicos, centros educativos y asociaciones desarrollarán estas iniciativas relativas a la reutilización de residuos, la biodiversidad, la visibilización del talento femenino o la mejora de los barrios con aportaciones de las personas mayores, en las provincias de Granada, Málaga, Cádiz, Huelva y Sevilla hasta 2027.




