Desvelan un mecanismo que garantiza la precisión durante el desarrollo de los órganos
Un estudio liderado por investigadores del CSIC identifica el mecanismo que ajusta el número de células que se diferencian para formar un órgano, asegurando el tamaño adecuado del mismo. El trabajo, que ha sido publicado en la revista PLOS Biiology, utiliza el ojo de Drosophila, la mosca del vinagre, como un «aparato óptico» biológico de referencia.
Fuente: CSIC Comunicación Andalucía y Extremadura
En la naturaleza, la mayor parte de los órganos del cuerpo terminan de crecer cuando alcanzan un tamaño propio de la especie. Un hecho que es sorprendente, porque en el desarrollo de cualquier órgano hay involucradas una gran cantidad de células, que crecen, se dividen, se especializan o mueren y en todos estos procesos hay fluctuaciones. Se esperaría, por tanto, que la formación de los órganos fuese un proceso impreciso –pero no lo es.
¿Cómo se consigue? La teoría hasta ahora era que el desarrollo embrionario está dotado de mecanismos de control semejantes a los que se implementan en los sistemas de ingeniería para, por ejemplo, garantizar la constancia de la producción en una planta industrial o la estabilidad en el vuelo de un avión. Sin embargo, un nuevo trabajo publicado en PLOS Biology describe, de hecho, un mecanismo de control “retroalimentado” que explicaría cómo se garantiza la estabilidad del desarrollo de un órgano.
Dos equipos de investigación de la conexión lifeHUB del Consejo Superior de Investigaciones Científicas (CSIC) han sido los encargados de descubrir este mecanismo por el que las células indiferenciadas (células madre) que van a dar origen a los distintos tipos celulares de un órgano concreto se producen en una cantidad que se ajusta al número de células que se diferencian, por lo que el tamaño final del órgano tiene poca variabilidad, es decir, es consistente.
El trabajo ha estado liderado por liderados por Fernando Casares en el Centro Andaluz de Biología del Desarrollo (CABD-CSIC/UPO/JA), y por Saúl Ares en el Centro Nacional de Biotecnología (CNB-CSIC) y ha contando con la participación de investigadores de la Universidad Carlos III de Madrid y de la Universidad de Oporto.
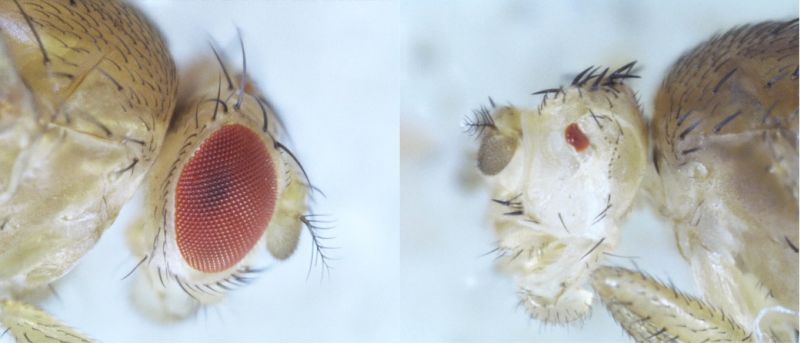
Si durante el desarrollo de Drosophila (izquierda) se atenúa la vía de BMP, los ojos resultantes son considerablemente más pequeños (derecha) (F. Casares/ CABD).
El equipo de Casares del CABD ha elegido el ojo de Drosophila melanogaster, la mosca del vinagre, como órgano modelo en su estudio. “Esta elección se justifica porque es un «aparato óptico» biológico, en el que la precisión de su tamaño es esencial para su función”. Fernando Casares explica que “el mecanismo de ajuste funciona mediante un sistema de retroalimentación: las células progenitoras se producen de forma continua, pero su supervivencia está supeditada a que reciban una señal de las células que se están diferenciando.
Esta señal se produce a través de la familia de proteínas BMP, moléculas conservadas en todos los grupos animales y esenciales para múltiples funciones, desde el establecimiento de las capas embrionarias hasta el desarrollo del sistema nervioso”.
Saúl Ares, investigador del CNB comenta que “este trabajo ha sido posible gracias a la combinación de las distintas capacidades y metodologías de ambos grupos y utilizando un conjunto de tecnologías, desde la ingeniería genética al análisis cuantitativo de imágenes y modelización matemática, que ha permitido demostrar que la formación del ojo depende de este mecanismo de retroalimentación con la familia BMP como protagonista”.
Nuevas vías de investigación
La historia de la biología nos dice que, a menudo, los descubrimientos que se hacen en sistemas modelo como Drosophila son trasladables a otros organismos, incluidos los seres humanos. De manera más general, el mecanismo de control de la variabilidad que se ha descrito para el ojo de la mosca del vinagre podría estar operativo durante el desarrollo de otros órganos en distintos organismos.
Tomás Navarro, investigador del grupo de Casares en el CABD y primer autor del trabajo, destaca las posibilidades que abren estos resultados: “Por el momento no se conoce por qué las células progenitoras tienen una tendencia a morir, ni cuáles son las rutas bioquímicas específicas por las que la vía de señalización BMP previene esta muerte. Sin embargo, este fenómeno resulta muy interesante ya que las señales de la familia BMP están involucradas en el desarrollo de tumores y podrían tener implicaciones en la salud. Otra cuestión crucial para futuros estudios es la resiliencia de estos mecanismos de control ante variaciones genéticas o ambientales, e identificar los puntos vulnerables de estos sistemas de control del desarrollo”, concluye.
Referencia:
Navarro, A.Iannini, M.Neto, A.Campoy-Lopez, J.Muñoz-Garcia, P.S.Pereira, S.Ares, F.Casares. ‘Feedback control of organ size precision is mediated by BMP2-regulated apoptosis in the Drosophila eye’. PLOS Biology 2024.
Últimas publicaciones
Para conmemorar el Día de las Matemáticas (14 de marzo), la Fundación Descubre organiza estos encuentros donde investigadores […]
Sigue leyendoLa participación está abierta a: municipios de menos de 50.000 habitantes, así como a colectivos sociales y en riesgo de exclusión.
Sigue leyendoUn equipo de la Universidad de Sevilla descubre una diversidad genética inesperada en un grupo de tomillos ibéricos. El trabajo, basado en técnicas genómicas de última generación, revela linajes ocultos y plantea nuevos retos para la conservación de estas plantas tan emblemáticas.




